Sistemi CRISPR-Cas: rivoluzionare la tecnologia di editing del genoma

CRISPR-Cas9: sbloccare l'editing di precisione del genoma per scoperte rivoluzionarie in medicina, agricoltura e non solo.

La scoperta di CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats) e delle proteine Cas associate ha democratizzato l'editing del genoma, offrendo una precisione e una versatilità senza precedenti. Pionieristico grazie al lavoro fondamentale di Doudna e Charpentier (2012), CRISPR-Cas9 sfrutta un meccanismo di difesa batterica per creare rotture mirate a doppio filamento del DNA, consentendo un'efficace eliminazione o inserimento genico via riparazione mediata da omologia (HDR). Da allora, i sistemi CRISPR si sono diversificati, con innovazioni come gli editori di basi, gli editori primari e l'interferenza CRISPR (CRISPRi/a) che ampliano la cassetta degli attrezzi per l'ingegneria del genoma di precisione.
I sistemi CRISPR-Cas operano via un meccanismo a due componenti in cui l'RNA guida (gRNA) indirizza l'endonucleasi Cas9 a una specifica localizzazione genomica, portando a rotture a doppio filamento (DSB) (Zakrzewska e Burmistrz, 2023). Queste rotture vengono poi riparate tramite unioni terminali non omologhe (NHEJ) o riparazione mediata da omologia (HDR), consentendo un'editing genico preciso (Zakrzewska e Burmistrz, 2023). L'intero processo può essere suddiviso in tre fasi: riconoscimento, scissione e riparazione (Asmamaw e Zawdie, 2021). Inizialmente, il complesso Cas9: sgRNA si lega al DNA (Bhattacharya e Satpati, 2022). L'crRNA maturo viene incorporato nel complesso effettore e cerca sequenze complementari al suo frammento spacer (Zakrzewska e Burmistrz, 2023). Per i sistemi di tipo II Classe 2, il complesso proteico Cas9, insieme a crRNA maturo e tracrRNA, scandisce il DNA alla ricerca di un motivo adiacente al protospacer (PAM) (Zakrzewska e Burmistrz, 2023). Il riconoscimento della sequenza complementare induce una struttura a loop R, portando a una scissione del doppio filamento tramite i domini HNH e RuvC (Zakrzewska e Burmistrz, 2023).
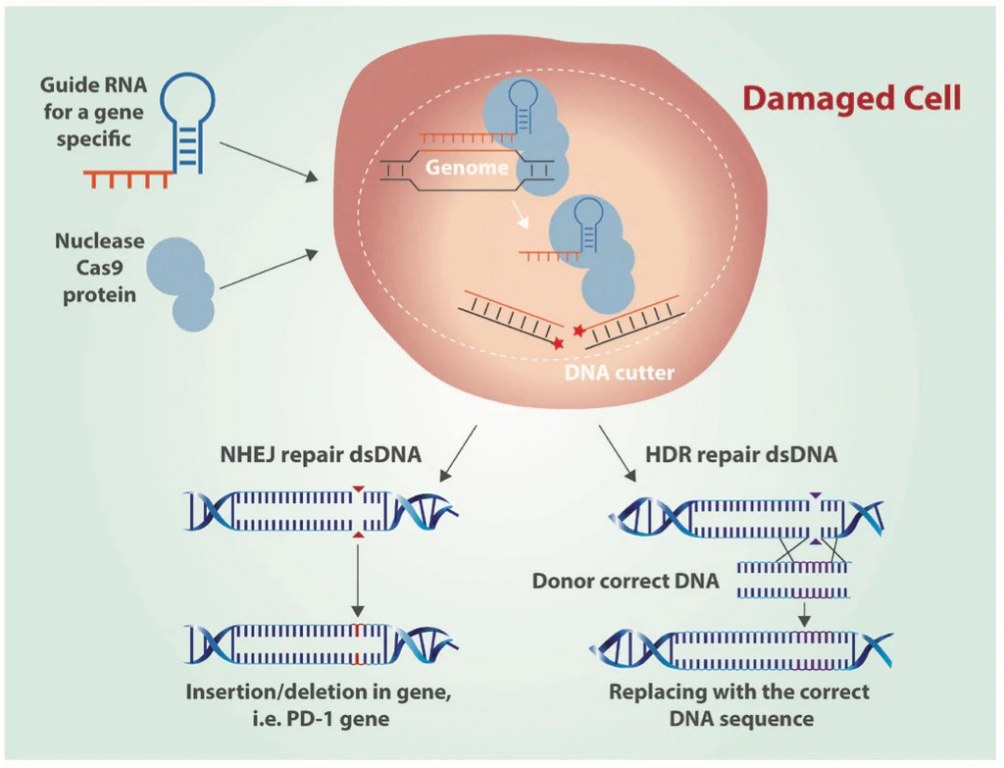
Figura 1: Editing genico tramite CRISPR Cas9 utilizzando l'unione terminale non omologa (NHEJ) e la riparazione mediata da omologia (HDR) (Castillo, 2016).
Applicazioni
Terapia genica
Una delle applicazioni più promettenti della tecnologia CRISPR-Cas risiede nella terapia genica. Mirando direttamente alle mutazioni genetiche responsabili delle malattie, i ricercatori possono potenzialmente correggere questi difetti alla radice. Successi degni di nota includono l'editing del gene CCR5 nelle cellule T umane per conferire resistenza all'infezione da HIV (Zhu, 2022). Inoltre, CRISPR è stato utilizzato per sviluppare modelli murini che simulano malattie umane, facilitando lo studio dei meccanismi fisiopatologici e delle strategie terapeutiche (Cribbs e Perera, 2017).
Medicina di precisione
La capacità di CRISPR di modificare i geni con precisione apre nuove strade per la medicina personalizzata. Personalizzando i trattamenti in base alla composizione genetica di un individuo, CRISPR può migliorare l'efficacia terapeutica riducendo al minimo gli effetti collaterali. Ad esempio, la ricerca in corso sta esplorando la sua applicazione nella terapia contro il cancro, mirata a oncogeni e geni soppressori dei tumori per inibire la crescita tumorale (Zhu, 2022).
Biotecnologia agricola
Oltre alla salute umana, i sistemi CRISPR-Cas stanno rivoluzionando le pratiche agricole. La tecnologia consente lo sviluppo di colture con caratteristiche migliorate come la resistenza alle malattie, la tolleranza alla siccità e i profili nutrizionali migliorati. Questo avanzamento biotecnologico promette di affrontare le sfide della sicurezza alimentare causate dai cambiamenti climatici e dalla crescita della popolazione (Zhu, 2022).
I sistemi CRISPR-Cas rappresentano una svolta nell'ingegneria genetica con implicazioni di vasta portata in vari settori. Man mano che la ricerca continua a rivelare il pieno potenziale di questa tecnologia, è fondamentale che gli scienziati si impegnino in pratiche responsabili che diano priorità alla sicurezza e alle considerazioni etiche. Il futuro della biologia di precisione dipende dalla nostra capacità di sfruttare questi potenti strumenti affrontando le complessità che essi presentano.
In sintesi, la tecnologia CRISPR-Cas è in prima linea nell'innovazione scientifica, offrendo soluzioni trasformative per le malattie genetiche e le sfide agricole. L'esplorazione continua e il dialogo sulle sue applicazioni saranno cruciali mentre ci dirigiamo verso un futuro in cui l'editing genetico preciso diventa una pratica standard in medicina e biotecnologia.
Riferimenti
Doudna, J.A. e Charpentier, E., 2014. The new frontier of genome engineering with CRISPR-Cas9. Science, 346(6213), p.1258096.
Zakrzewska, M. e Burmistrz, M., 2023. Mechanisms regulating the CRISPR-Cas systems. Frontiers in Microbiology, 14, p.1060337.
Asmamaw, M. e Zawdie, B., 2021. Mechanism and applications of CRISPR/Cas-9-mediated genome editing. Biologics: targets and therapy, pp.353-361.
Bhattacharya, S. e Satpati, P., 2022. Insights into the mechanism of CRISPR/Cas9-based genome editing from molecular dynamics simulations. ACS omega, 8(2), pp.1817-1837.
Castillo, A., 2016. Gene editing using CRISPR-Cas9 for the treatment of lung cancer. Colombia Médica, 47(4), pp.178-180.
Zhu, Y., 2022. Advances in CRISPR/Cas9. BioMed research international, 2022(1), p.9978571.
Cribbs, A.P. e Perera, S.M., 2017. Focus: Genome editing: Science and bioethics of CRISPR-Cas9 gene editing: An analysis towards separating facts and fiction. The Yale journal of biology and medicine, 90(4), p.625.

