CRISPR-Cas-systemen: Een revolutie in genoombewerkingstechnologie

CRISPR-Cas9: Het ontsluiten van precisie genoombewerking voor doorbraken in de geneeskunde, landbouw en daarbuiten.

De ontdekking van CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats) en de bijbehorende Cas-eiwitten hebben de genoombewerking gedemocratiseerd, met ongekende precisie en veelzijdigheid. Geïnitieerd door het fundamentele werk van Doudna en Charpentier (2012), maakt CRISPR-Cas9 gebruik van een bacterieel verdedigingsmechanisme om gerichte dubbelstrengige DNA-breuken te creëren, wat efficiënte genknock-out of knock-in mogelijk maakt via homologie-gestuurde reparatie (HDR). Sindsdien zijn CRISPR-systemen gediversifieerd, met innovaties zoals base editors, prime editors en CRISPR-interferentie (CRISPRi/a) die de gereedschapskist voor precisiegenetische engineering uitbreiden.
CRISPR-Cas-systemen werken via een tweedelig mechanisme waarbij geleide RNA (gRNA) de Cas9-endonuclease naar een specifieke genomische locatie leidt, wat leidt tot dubbelstrengige breuken (DSB's) (Zakrzewska en Burmistrz, 2023). Deze breuken worden vervolgens gerepareerd door middel van niet-homologe uiteinde samensmelting (NHEJ) of homologie-gestuurde reparatie (HDR), wat nauwkeurige genbewerking mogelijk maakt (Zakrzewska en Burmistrz, 2023). Het gehele proces kan worden onderverdeeld in drie fasen: herkenning, knippen en reparatie (Asmamaw en Zawdie, 2021). Aanvankelijk bindt het Cas9: sgRNA-complex aan DNA (Bhattacharya en Satpati, 2022). Volwassen crRNA wordt geïntegreerd in het effectorcomplex en zoekt naar sequenties die complementair zijn aan zijn spacerfragment (Zakrzewska en Burmistrz, 2023). Voor Class 2 Type II-systemen scant het Cas9-eiwitcomplex, samen met volwassen crRNA en tracrRNA, DNA op een protospacer-adjacente motif (PAM) (Zakrzewska en Burmistrz, 2023). Het herkennen van de complementaire sequentie induceert een R-lusstructuur, wat leidt tot een dubbelstrengs breuk via de HNH- en RuvC-domeinen (Zakrzewska en Burmistrz, 2023).
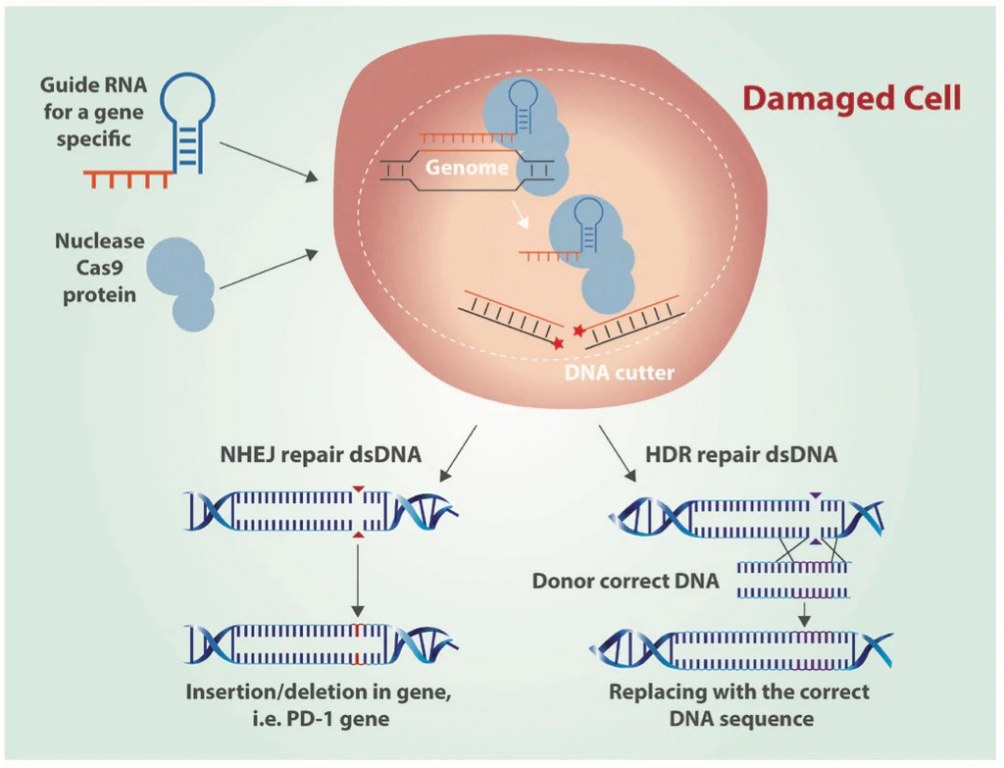
Figuur 1: Genbewerking door CRISPR Cas9 DNA met niet-homologe uiteinde samensmelting (NHEJ) en homologie-gestuurde reparatie (HDR) (Castillo, 2016).
Toepassingen
Gentherapie
Een van de veelbelovende toepassingen van CRISPR-Cas-technologie ligt in gentherapie. Door genetische mutaties die verantwoordelijk zijn voor ziekten direct aan te pakken, kunnen onderzoekers deze defecten mogelijk bij de bron corrigeren. Opmerkelijke successen zijn onder andere het bewerken van het CCR5-gen in menselijke T-cellen om weerstand tegen HIV-infectie te bieden (Zhu, 2022). Bovendien is CRISPR gebruikt om muismodellen te ontwikkelen die menselijke ziekten nabootsen, waardoor het mogelijk wordt de pathofysiologische mechanismen en therapeutische strategieën te bestuderen (Cribbs en Perera, 2017).
Precisie Geneeskunde
De mogelijkheid van CRISPR om genen met precisie te bewerken opent nieuwe mogelijkheden voor gepersonaliseerde geneeskunde. Door behandelingen af te stemmen op de genetische samenstelling van een individu, kan CRISPR de therapeutische effectiviteit verbeteren en bijwerkingen minimaliseren. Onderzoek is bijvoorbeeld bezig met de toepassing ervan in kankertherapie door oncogenen en tumorsuppressorgenen aan te pakken om tumorgroei te remmen (Zhu, 2022).
Landbouwbiotechnologie
Naast de menselijke gezondheid, revolutioneren CRISPR-Cas-systemen de landbouwpraktijken. De technologie maakt het mogelijk om gewassen te ontwikkelen met verbeterde eigenschappen, zoals ziektebestendigheid, droogtetolerantie en verbeterde voedingsprofielen. Deze biotechnologische vooruitgang belooft te helpen bij het aanpakken van voedselbeveiligingsproblemen die worden veroorzaakt door klimaatverandering en bevolkingsgroei (Zhu, 2022).
CRISPR-Cas-systemen vertegenwoordigen een baanbrekende vooruitgang in genetische engineering met verreikende implicaties op verschillende gebieden. Terwijl het onderzoek de volledige potentie van deze technologie blijft onthullen, is het van essentieel belang dat wetenschappers verantwoordelijke praktijken hanteren die veiligheid en ethische overwegingen prioriteren. De toekomst van precisiebiologie hangt af van ons vermogen om deze krachtige tools te benutten, terwijl we de complexiteit ervan navigeren.
Samenvattend staat CRISPR-Cas-technologie aan de voorhoede van wetenschappelijke innovatie, met transformerende oplossingen voor genetische ziekten en landbouwuitdagingen. Vervolgonderzoek en dialoog over de toepassingen ervan zullen cruciaal zijn naarmate we vooruitgaan naar een toekomst waarin nauwkeurige genetische bewerking een standaardpraktijk wordt in de geneeskunde en biotechnologie.
Referenties
Doudna, J.A. en Charpentier, E., 2014. De nieuwe frontier van genoomengineering met CRISPR-Cas9. Science, 346(6213), p.1258096.
Zakrzewska, M. en Burmistrz, M., 2023. Mechanismen die de CRISPR-Cas-systemen reguleren. Frontiers in Microbiology, 14, p.1060337.
Asmamaw, M. en Zawdie, B., 2021. Mechanisme en toepassingen van CRISPR/Cas-9-gemedieerde genoombewerking. Biologics: targets and therapy, pp.353-361.
Bhattacharya, S. en Satpati, P., 2022. Inzichten in het mechanisme van CRISPR/Cas9-gebaseerde genbewerking via moleculaire dynamicasimulaties. ACS omega, 8(2), pp.1817-1837.
Castillo, A., 2016. Genbewerking met CRISPR-Cas9 voor de behandeling van longkanker. Colombia Médica, 47(4), pp.178-180.
Zhu, Y., 2022. Vooruitgangen in CRISPR/Cas9. BioMed Research International, 2022(1), p.9978571.
Cribbs, A.P. en Perera, S.M., 2017. Focus: Genbewerking: Wetenschap en bio-ethiek van CRISPR-Cas9-genbewerking: Een analyse om feiten van fictie te scheiden. The Yale Journal of Biology and Medicine, 90(4), p.625.

